�^���p�N���f�U�C���EAI�n��E���������w
������w �V�䌤�����ł́A��Â�Y�Ƃɖ𗧂^���p�N���̐V�K�f�U�C����ڎw���������Ɨ��_�I�������s���Ă��܂��B���ɁA�Ő�[�̃^���p�N���v�@����g���āA�E�C���X�����A����A�A�����M�[�Ȃǂ̎������^�[�Q�b�g�ɂ����n���ڎw���Ă��܂��B�܂��A�o�C�I�R���Ȃǂ̗L�p�����������I�ɐ��Y�ł���y�f�̊J���ɂ����g��ł��܂��B����ɁA�^���p�N���̃t�H�[���f�B���O�@�\�Ȃǂ̊�b�������s���A�v�V�I�ȃ^���p�N���f�U�C���@���J�����܂��B���ꂩ��̐����Ȋw�ɂ͎����Ɨ��_�̗������K�v�ł���A���������ł͂����̗������ł���l�ނ��琬���܂��BAI�Ȃǂɂ�锭�W���ڊo�܂����^���p�N���f�U�C�������ɁA�F������ꏏ�ɒ��킵�܂��H�@���_�����̖��o���҂����}���܂��B�������̖ڕW�́ADNA�ɏ����ꂽ�u�����̃v���O�����v�������������A���̒m�����A�Y�Ƃ��Âɖ𗧂Ă邱�Ƃł��B�����̃v���O�����̉�ǂ́A�����Ȋw�̎���ƌĂ�鍡���I�̍ŏd�v�ۑ�ł��B���̖��̉������Ȋw�ƎЉ�ɗ^����C���p�N�g�́A�����@���̔����Ɠ����ȏ�ł���A�l�ނ̎����I���W�ɑ傫����^���邱�Ƃ����҂���܂��B
�V�䌤�����ł́A���̖ڕW�Ɍ������āA���̂悤�Ȍ������s���Ă��܂��B���ɁA�ߔN���ڂ���Ă���f�W�^���E�g�����X�t�H�[���[�V�����iDX�j��A�O���[���E�g�����X�t�H�[���[�V�����iGX�j�Ɍ��������g�݂ɗ͂����Ă��܂��B�܂��A�����Ȋw�E�����w�E���Ȋw��Z�������A���_�Ǝ����̗��ʂ��猤����i�߂Ă��܂��B
�P�D��Â�Y�Ƃɖ𗧂^���p�N�����f�U�C������
�i�P�j�R����܁E�R�A�����M�[��E�R�E�C���X��Ƃ��ė��p�\�ȐV�K�^���p�N���̐v
�i�Q�j�o�C�I�G�l���M�[������
�i�R�j�y�f���������コ���镁�ՓI��@�̊J��
�i�S�j����`�w�i�I�v�g�W�F�l�e�B�N�X�j�ɗ��p�\�ȃ^���p�N���̗��_�I�v
�i�T�j�זE���ɑ��݂��镨�����ʂ��邽�߂̃Z���T�[�^���p�N���̊J��
�i�U�j�R�̐����ɖ𗧂A�t�B�j�e�B�[���K���h�̑n��
�i�V�j�_�Ɛ��Y�����������邽�߂̗L�p�y�f�̊J��
�Q�D�^���p�N���̃t�H�[���f�B���O��������
�i�P�j�^���p�N���̃t�H�[���f�B���O�����@�\�̉� �`�|�X�gAlphaFold2����ɂ�����V���Ȍ���
�i�Q�j�V�R�ϐ��^���p�N���̋@�\�����@�\�̉𖾂Ƒn��ւ̉��p
�i�R�j�^���p�N���̍\���_�C�i�~�N�X��͂Ƌ@�\����@�̊J��
�i�S�j�H�i�^���p�N���̕������
�i�T�j�זE���ł́u�t-�t�������v�̃��J�j�Y���𖾂Ɛ���@�̊J��
�i�U�j�~���[�^�m�[����͂Ɋ�Â��^���p�N���\�z�����̉�
�^���p�N���̃t�H�[���f�B���O���Ƃ�
�^���p�N���̕��������Ƃ�
�^���p�N���H�w�Ƃ�
����ɂ���
�P�D��Â�Y�Ƃɖ𗧂^���p�N�����f�U�C������
�@���̓��ł̗l�X�Ȕ�����S���Ă���̂́ADNA�ł͂Ȃ��A�^���p�N���ł��B�^���p�N���́A�G�}�⌋���Ƃ�����������ʂ��āA�����Y������A�a���̂Ɍ��������肵�āA�������ێ����Ă��܂��B���̂悤�ȓ����́A�Y�Ƃ��Âɂ��𗧂��܂��B�ړI�ɉ����āA���ɗ��^���p�N�������R���݂Ƀf�U�C�����邱�Ƃ��ł�����A�������̐����͂ƂĂ��L���Ȃ��̂ɂȂ�ł��傤�B�^���p�N���̃t�H�[���f�B���O���̉����́A���̂悤�Ȗ����ƒ������Ă��܂��B�t�H�[���f�B���O���͊m���ɓ��ł����A�����ɐi�W���Ă���A�����炭�����I���ɉ�����������A�Y�Ƃ��Â̌���Ń^���p�N�����傢�ɖ𗧂�������Ɗ��҂��Ă��܂��B
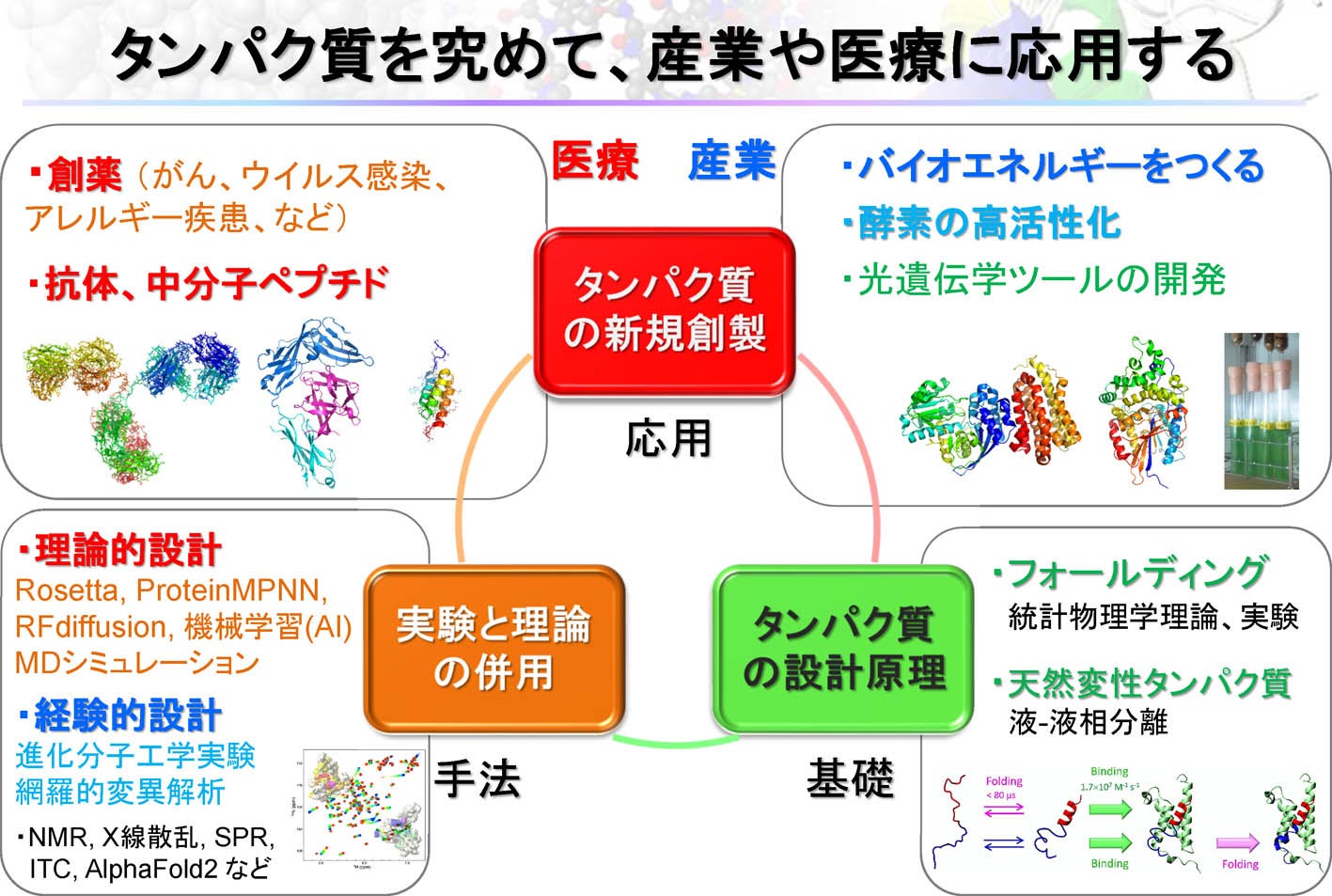
�@�������́A���ۂɗL�p�^���p�N����v���쐻���邱�Ƃɂ���āA�f�U�C���@�W�����A�t�H�[���f�B���O�@�\�̗�����[�߂邱�Ƃ�ڎw���Ă��܂��B��̓I�ɂ́A���̂Q�̎�@��p���āA�ȉ��̖ڕW�P�`�U�̂悤�ȃ^���p�N���̃f�U�C���Ɏ��g��ł��܂��B
�m��@�P�D���_�I�v�n�@�v�Z�@��p���ėL�p�ȐV�K�^���p�N���𗝘_�I�ɐv���A�Y�Ƃ��Âɉ��p�ł���A�������̐����͈�ς���ł��傤�B���Ɛ��\�N��ɂ͂��̂悤�Ȏ��オ����Ɗ��҂���Ă��܂��B���ݎ������́A���̂悤�Ȗ��̎����Ɍ����āA���i�̊J���Ȃǂɖ𗧂^���p�N���̗��_�I�v�Ɏ��g��ł��܂��B
�@��̓I�ɂ́ARosetta�Ƃ����^���p�N�����q�v�\�t�g�E�F�A��p���āA�^�[�Q�b�g���q�Ɍ�������^���p�N����A�G�}�������N�����y�f�̗��̍\���ƃA�~�m�_�z���v���܂��B���̂��ƁA���ۂɃ^���p�N�����쐻���A�v�ʂ�̋@�\��L���邱�Ƃ��m�F���܂��B���_�Ǝ����̗������ł��錤���҂��琬���邱�Ƃ����������̖ڕW�̈�ł��B
�@Rosetta�͕����w�x�[�X�̎�@�ł���̂ɑ��A�ŋ߂�AlphaFold 2�AProtein MPNN�ARFDiffusion�Ȃǂɑ�\�����[�w�w�K�x�[�X�̎�@���}���ɔ��W���Ă��܂��B�[�w�w�K�x�[�X�̎�@�̓^���p�N���f�U�C����e�Ղɂ��܂������A�v�̐������͂܂������Ƃ͌����܂���B���ɁA�y�f�Ȃǂ̂悤�ɁA�_�C�i�~�N�X�i�����j���d�v�ȃ^���p�N���̐v�͈ˑR�Ƃ��č���ł��B�����Ŏ������́A�����w�x�[�X�̎�@�Ɛ[�w�w�K�x�[�X�̎�@��g�ݍ��킹�邱�ƂŁA�^���p�N���v�̐����������߂邽�߂̎�@�J����i�߂Ă��܂��B���̂悤�Ȑv���@�́A���݂̃^���p�N���f�U�C������ɂ�����Ő�[��@�ł��B�܂��A���ݒ��ڂ���Ă���f�W�^���E�g�����X�t�H�[���[�V�����iDX�j�Ƃ܂��ɍ��v�������g�݂ɂȂ�܂��B
�m��@�Q�D�i�����q�H�w�����n�@��ʂ̕ψّ̂������_���ɁA�������͖ԗ��I�ɍ\�z���A���̒����獂�@�\�������ψّ̂��X�N���[�j���O���܂��B������J��Ԃ��āu�l�H�i���v�������ɍs���A�L�p�^���p�N����n�o���܂��B�����2018�N�Ƀm�[�x�����w�܂���܂����d�v�Ȍ�����@�ł��B
�@�Ȃ��A�m�[�x���܂��o������̉�������Ɏ��̃m�[�x���܂�����ƌ����Ă��܂��B�i�����q�H�w�����ɂ��^���p�N���f�U�C���̎��́A���_�I��@�ɂ��^���p�N���f�U�C���ɑ��ăm�[�x���܂����^�����̂ł͂Ȃ����Ɗ��҂���Ă��܂��B
�i�ڕW�P�j�R����܁E�R�A�����M�[��E�R�E�C���X��Ƃ��ė��p�\�ȐV�K�^���p�N���̐v
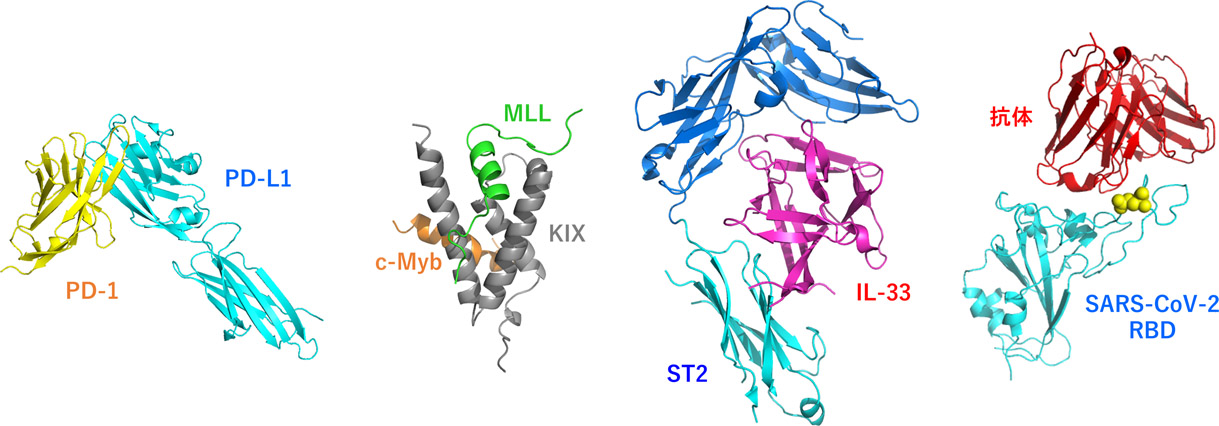
�@���̓��ł́A�Ⴆ��A��B�Ƃ���2�̃^���p�N�����m����������ƃK���זE�����B������A�A�����M�[�������N������A�E�C���X�������N�����肷��Ƃ������P�[�X�����X�����܂��B�����̃^���p�N���Ԍ�����j�Q���镨������邱�Ƃ��ł���A�R����܁E�R�A�����M�[��E�R�E�C���X��Ƃ��Ďg�p�ł���Ɗ��҂���܂��B��̓I�ɂ́AA�Ƃ����^���p�N����B����������������^���p�N����AB�Ƃ����^���p�N����A����������������^���p�N������邱�Ƃ��ł���Ηǂ��킯�ł��B�@�����Ŏ������́A���̂悤�ȃ^���p�N����y�v�`�h���A���܂��܂ȗ��_�I�v�@�ɂ���ĐV�K�n�����邱�Ƃ�ڎw���Č�����i�߂Ă��܂��B���ɁA����A�����a�A�A�����M�[���b���A�V�^�R���i�E�C���X�����ǁiCOVID-19�j�ɑ���n���i�߂܂��B��̓I�ɂ́APD-1/PD-L1�Ac-Myb/MLL/CBP(KIX)�AIL-33/ST2/IL-1RAcP�ASARS-CoV-2 Spike RBD/�R�̂Ȃǂ̃^���p�N���ԑ��ݍ�p���^�[�Q�b�g�ɂ��Ă��܂��B�܂��A��ƂƂ̋����������s���Ă��܂��B
�@�^���p�N���ԑ��ݍ�p�̑j�Q��Ƃ��Ă͍R�̂��L���ł��B�������R�̂͋���ȃ^���p�N���ł���A���̐����R�X�g���������߂ɍ��z�Ȉ��i�ƂȂ��Ă��܂��B�����Ŏ������́A�������e�Ղȏ��^�^���p�N����p���邱�ƂŁA�]���̍R�̂ɑ���u�V�^���^�R�́v�̊J����i�߂Ă��܂��B�������A���_�I�v�ɂ���Ă���������ł���A�������J�����啝�ɒጸ�����A���i�̉��i�������邱�Ƃɂ��v��������Ɗ��҂���܂��B
�@�V�^�R���i�E�C���X�����ǁiCOVID-19�j�ɂ���Đ��E���̐l�X�͑傫�ȉe�����܂����B�ߔN��6-7�N���ƂɐV���E�C���X���o�����Ă��邽�߁A������܂������悤�ȃp���f�~�b�N���N����\��������܂��B���̂Ƃ��ɐv���ɑΉ��ł���悤�ɂ��邽�߂ɂ��A�������̓E�C���X������j�~�ł���j�Q�܂̗��_�I�E�����I�ȊJ���ɂ����g��ł��܂��B
�i�ڕW�Q�j�o�C�I�G�l���M�[������
�@�����{��k�Ќ�A�k�Е����̂��߂ɁA�����Ȋw�����̗��ꂩ��A�������ɂł��邱�Ƃ͂Ȃ����낤���H�@�������Ȃ�ɐ^���ɍl���A�o�����������A�u�o�C�I�G�l���M�[������v�Ƃ������Ƃł����B���̊Ԃ̌o�܂ɂ��ẮA���̃����N�����Q�Ƃ��������B�@�@�@�@�u�o�C�I�G�l���M�[������@�`�������̌��ӕ\���v
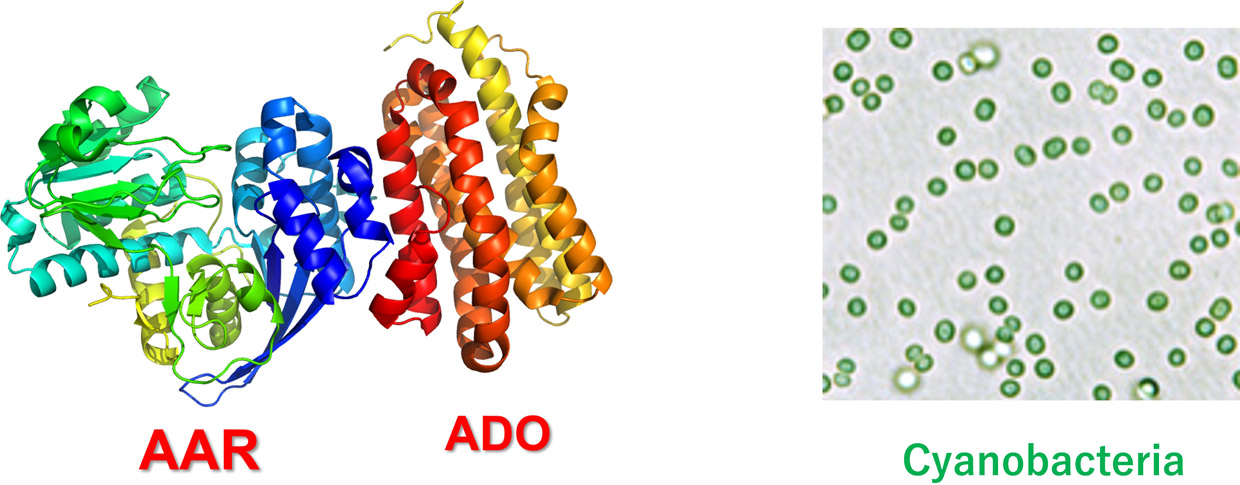
�@�o�C�I�G�l���M�[�Ƃ́A������������y���A�d���A�G�^�m�[���A���f�Ȃǂ̂��Ƃł���A���Ύ����⌴�q�͔��d�Ȃǂɑ�ւ���G�l���M�[�Ƃ��Ē��ڂ��W�߂Ă��܂��B�������Ȃǂ̑��ނ́A�y����d���ɑ�������A���J���i�Y�����f�j����邱�Ƃ��ł��܂��B���̂悤�Ȑ����������Y���邽�߂ɂ́A�������̃^���p�N���i�y�f�j�������Ă���͂��ł��B�����̃^���p�N���������������A�A���J�����������I�ɍ��������ł���A�o�C�I�G�l���M�[���Y�̎��p�������ł͂���܂���B�܂��A���ނ͌������ɂ���ăA���J���������ł��邽�߁A�R���̎g�p��ɔr�o���ꂽ��_���Y�f���ĂєR���ɖ߂����Ƃ��ł��܂��B���������āA���ނɂ��o�C�I�G�l���M�[���Y�́A�u�J�[�{���E�j���[�g�����v�ȍĐ��\�G�l���M�[�ƈʒu�Â��邱�Ƃ��ł��܂��B�ߔN�A���̂悤�Ȏ��g�݂̓O���[���E�g�����X�t�H�[���[�V�����iGX�j�Ƃ��Ă�Ă��܂��B
�@�������͌��݁A�������R���̃A���J�������֘A�y�f�ł���AAR��ADO�ɒ��ڂ��A�����������������āA�y���̐��Y���������������邱�Ƃ�ڎw����������W�J���Ă��܂��B���̖ڕW�B���̂��߂ɂ́A�ԗ��I�ψى�́A�i�����q�H�w�A�w���\����́ANMR�@�A�v�Z�@���f�����O�ȂǁA��i��I���ɁA�S�͂Ŏ��g��ł����܂��B
�i�ڕW�R�j�y�f���������コ���镁�ՓI��@�̊J��
�@Rosetta�\�t�g�E�F�A��p�������_�I�ȃ^���p�N���v�ł́A�^���p�N���Ԃ̌��������߂�ψّ̂̐v�Ȃǂ������s���Ă��܂��B�������A�y�f�����𗝘_�I�ɍ���������������͂قƂ�ǂȂ��A������\�Ƃ��镁�ՓI�Ȏ�@�̊J���͏d�v�ȉۑ�ƂȂ��Ă��܂��B�������͍ŋ߁A������\�Ƃ��闝�_�I��@�̊J���ɐ������܂����B���݂́A���̎�@�̕��Ր����m�F���邽�߂ɁA���܂��܂ȍy�f�ɖ{��@��K�p����������i�߂Ă��܂��B�i�ڕW�S�j�I�v�g�W�F�l�e�B�N�X�i����`�w�j�ɗ��p�\�ȃ^���p�N���̗��_�I�v
�@�I�v�g�W�F�l�e�B�N�X�i����`�w�j�Ƃ́A���Ń^���p�N���𑀍삷���`�w�I��@�̂��Ƃł���A�����Ȋw�����ɗ��p�ł��邾���łȂ��A��Âւ̉��p�����҂���Ă��܂��B����`�w�ɂ����ẮA���Ă��Ƃ��ɁA�^���p�N���̍\�����ω�������A�ʂ̃^���p�N���ƌ���������Ƃ����������������邱�Ƃ��d�v�ł��B�����ŁA���̂悤�Ȑ��䂪�\�ȃ^���p�N�����A���_�I��@���g���Đv���Ă��܂��B�i�ڕW�T�j�זE���ɑ��݂��镨�����ʂ��邽�߂̃Z���T�[�^���p�N���̊J��
�@�זE���ɑ��݂��镨���������ł���A���̕��������A�ǂ��ɁA�ǂ̂��炢���݂��Ă���̂��𖾂炩�ɂł��܂��B����ɂ���āA�a�C�̔��ǃ��J�j�Y���̉𖾂�A�����Ȋw�̊�b�����̔��W�ɍv���ł��܂��B���ݎ������́A���_�I��@��p���āA���̂悤�ȃZ���T�[�^���p�N���̊J���Ɏ��g��ł��܂��B�i�ڕW�U�j�R�̐����ɖ𗧂A�t�B�j�e�B�[���K���h�̑n��
�@�R�̂́A���̓��ł̖Ɖu�����ɂ�����d�v�ȃ^���p�N���ł���A�ۂ�E�C���X�Ȃǂ�F�����Č������A�a�C��h���ł��܂��B���݁A�R�͈̂��i�Ƃ��Ďg���n�߂Ă���A����p�̏��Ȃ���������i�Ƃ��Ē��ڂ���Ă��܂��B�@�R�͔̂|�{�זE�̒��ō���܂����A���̒�����R�݂̂̂����o���Đ�������Ƃ��ɂ́A�e�a���N���}�g�O���t�B�[�Ƃ�����@���p�����܂��B���̃N���}�g�O���t�B�[�p�J�����ɓ����Ă��闱�q�iResin�j�ɂ́A�R�݂̂̂Ɍ����ł���^���p�N���iProtein A�Ȃǁj���t������Ă��܂��B���̂悤�ȃ^���p�N���̂��Ƃ��A�A�t�B�j�e�B�[���K���h�ƌĂт܂��B����pH�ɂ����āA�|�{�t��e�a���J�����ɗ����ƁA�R�݂̂̂��J�����Ɍ������A�s�p�����͂��ׂĐ�����܂��B�ʏ�ł͎��ɁApH���_���ɂ��āA�R�̂��J����������O���܂��B�������A�R�͎̂_��pH�ŕ����I�ɕϐ����A�ÏW�̂��`������\��������܂��B���̂悤�ȋÏW�̂����i�ɍ�������ƁA����p����\�����w�E����Ă��܂��B
�@�����ŁA���S�E���S�Ȉ��i�����ɂ́A�ł��邾��pH�𒆐��ɋ߂������ōR�̂��J��������𗣂�����K�v������܂��B�������́A�t�H�[���f�B���O�������瓾��ꂽ�m�������p���āA���̂悤�ȃA�t�B�j�e�B�[���K���h�̃f�U�C�����s���Ă��܂��B
�i�ڕW�V�j�_�Ɛ��Y�����������邽�߂̗L�p�y�f�̊J��
�@�_�Ƃɂ����ă����͔엿�̏d�v�Ȑ����ł����A���̌����ł��郊���z��100�N�ȓ��Ɍ͊�����Ɨ\������Ă��܂��B����䂦�A�����I�ȐH�Ɛ��Y���\�Ƃ��邽�߂ɂ́A���ʂ̃����엿�ł����Ă��A���������I�Ƀ�������荞�߂�悤�ɂ��邱�Ƃ��K�v�ł��B���ݎ������́A������\�Ƃ���L�p�y�f�̊J���������߂Ă��܂��B
�Q�D�^���p�N���̃t�H�[���f�B���O��������
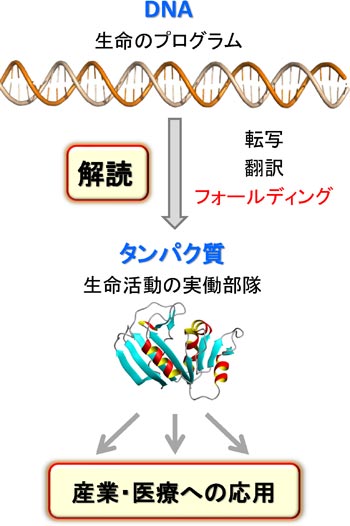
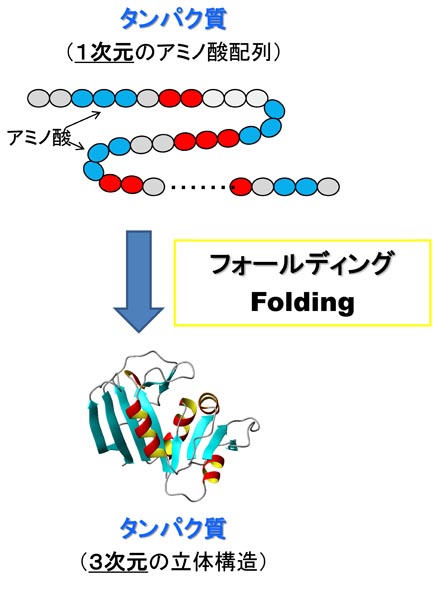
�@DNA�ɏ����ꂽ��`���́ARNA�ɓ]�ʂ���A�^���p�N���ւƖ|��܂��B�������ꂽ�^���p�N���́A�A�~�m�_������ɂȂ������ꎟ���I�ȕR�ɉ߂����A���̂܂܂ł͋@�\���ł��܂���B�R��̃^���p�N���́A���ٓI�ȎO�����̗��̍\�����`������i�t�H�[���f�B���O����j���Ƃɂ���ċ@�\���ł���悤�ɂȂ�܂��B�܂�A��`����̍ŏI�i�K�́A�^���p�N���̃t�H�[���f�B���O�Ƃ����v���Z�X�ł��B
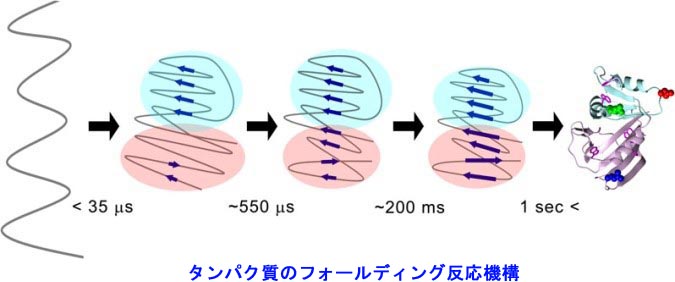
�@�ł́A����A�~�m�_�̔z�^����ꂽ�Ƃ��A�^���p�N���͂ǂ̂悤�ȗ��̍\�����`�����A�ǂ̂悤�ȋ@�\������̂ł��傤���H�@�܂��A�^���p�N���́A�ǂ̂悤�ɂ��ē��ٓI�ȗ��̍\���ւƃt�H�[���f�B���O����̂ł��傤���H�@�����̖��̂��āu�^���p�N���̃t�H�[���f�B���O���v�ƌĂт܂��B���̖��́A���̈�`�Í���ǖ��Ƃ��Ă�A50�N�ȏ���������̓��ł��B
�@2020�N�ɁA���̕���ɂ����Ċv���I�Ȃ��Ƃ��N���܂����B����́AAlphaFold 2�Ƃ����[�w�w�K�x�[�X�̃\�t�g�E�F�A�̏o���ł��BAlphaFold2�́A�A�~�m�_�z�����͂���ƁA���̃^���p�N�����Ƃ肤�闧�̍\���𐳊m�ɗ\�����Ă���܂��B���̗\�����x�́A�^���p�N���̗��̍\���������Ō��肷��̂Ɠ������炢�����A����̓^���p�N���̗��̍\������̌������s�v�ɂȂ�̂ł͂Ȃ����ƌ�����قǂł��B
�@�������AAlphaFold 2�ɂ��ł��Ȃ����Ƃ�����܂��B����́A�^���p�N���̃t�H�[���f�B���O�����ߒ���J�j�Y���̗\���ł��B�܂��A�^���p�N�����ǂ̂悤�ɓ����ċ@�\������̂��ɂ��Ă��\���ł��܂���B�^���p�N���͓���̍\���Ƀt�H�[���f�B���O������A�_�C�i�~�b�N�ɓ����ċ@�\�����܂��̂ŁAAlphaFold 2�ŗ��̍\����\�����邱�Ƃ��\�ɂȂ��Ă��A�^���p�N���̃t�H�[���f�B���O�@�\��_�C�i�~�N�X��\���ł���悤�ɂȂ�Ȃ���A�u�^���p�N���̃t�H�[���f�B���O���v���������Ƃ͌����܂���B�����Ŏ������́A���̏d�v�ۑ�̉�����ڎw���Č�����i�߂Ă��܂��B
�@���̖����������߂ɂ́A�����A�����A���w�A�o�C�I�C���t�H�}�e�B�N�X�A�^���p�N���H�w�Ȃǂ̎����I�E���_�I��@����g���A��i��I���Ɍ��������邱�Ƃ���ł��B�������̌������ł́A�l�X�ȃo�b�N�O���E���h�����l�������W�܂�A�V������@�̊J���Ɖ��p�A����сA�����Ɨ��_�̗Z����S�����Ȃ���A������i�߂Ă��܂��B��Ɏ��̂悤�ȃe�[�}�Ɏ��g��ł��܂��B
�i�P�j�^���p�N���̃t�H�[���f�B���O�����@�\�̉�
�@�@�`�|�X�gAlphaFold2����ɂ�����V���Ȍ����Ƃ�
�@���̓��ł���ꂽ�^���p�N�������ٓI�ȓV�R�\���ւƃt�H�[���f�B���O���Ă��������ߒ��́A����܂łɗl�X�Ȏ����ɂ���Ė��炩�ɂȂ����܂��B�������A���̔����ߒ��𗝘_�I�ɗ\���ł��ď��߂āA�^���p�N���̃t�H�[���f�B���O�����@�\���𖾂ł����ƌ����܂��B�����Ŏ������́A���v�͊w���_��p���āA�^���p�N�����Ƃ肤��\���́u���R�G�l���M�[�n�`�v��`�����Ƃ�ڎw���������Ɏ��g��ł��܂��B���̗��_��Wako-Saito-Munoz-Eaton (WSME) ���f���ƌĂ�Ă���A����܂łɁA�A�~�m�_�c���100�ȉ��̏����ȃ^���p�N���̃t�H�[���f�B���O�����ߒ��̗\���ɐ������Ă��܂����B�������A�^���p�N���̕��ϓI�ȃT�C�Y��200-300�c��ł���A������^���p�N���ɕ��ՓI�ɓK�p�\�ȗ��_�͂܂�����܂���ł����B�@�������͍ŋ߁A���̗��_��啝�ɉ��ǂ��A������^���p�N���ɓK�p�ł��闝�_�̍\�z�ɐ������܂����iOoka & Arai (2023) Nature Communications, 14: 6338)�B���̗��_�ɂ��A�Ⴆ�Ή��}�̂悤�Ȏ��R�G�l���M�[�n�`��`�����Ƃ��ł��A�^���p�N�����ǂ̂悤�Ȍo�H��ʂ��ăt�H�[���f�B���O���Ă����̂��������ɗ\���ł��܂��B�܂��A�������x�A�o�H��Ō`������\���Ȃǂ����ׂė\���\�ł��B�Ⴆ��Ȃ�A�܂�߂̌`�����������ŁA���̌`�ɂȂ�悤�Ȑ܂�������ׂė\���ł��邱�Ƃɑ������܂��B�܂��A�߂����łȂ��A�ǂ�Ȍ`�ł����Ă��A���̍�����\���ł��邱�Ƃɑ������܂��B
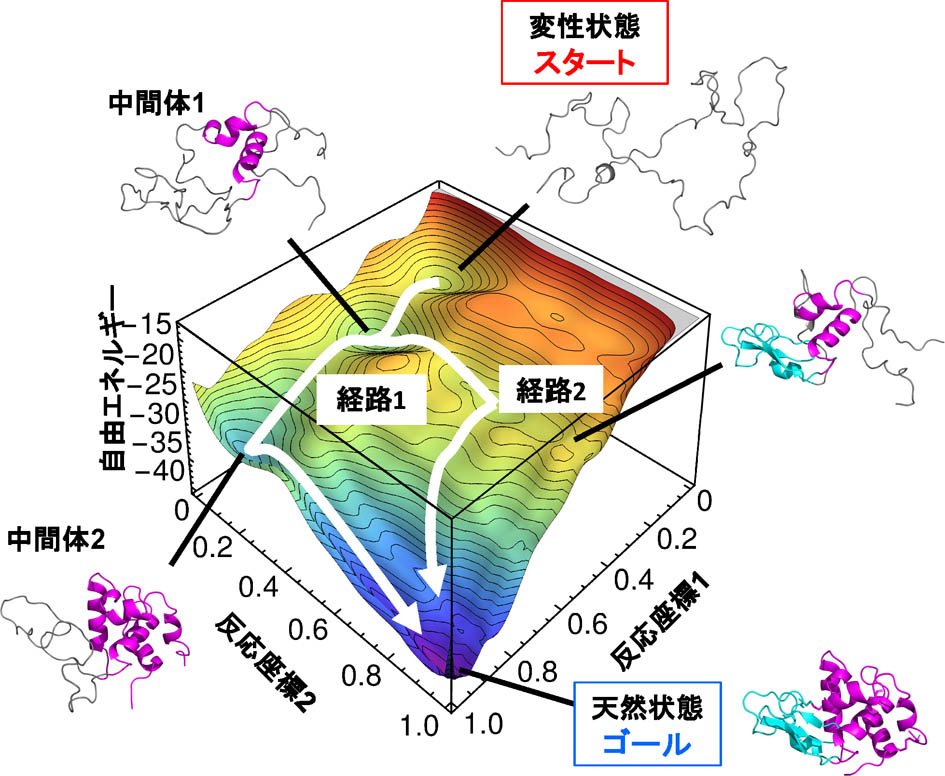
�@���ꂩ����ׂ����Ƃ͂�������܂��B�Ⴆ�A�@���̗��_�����܂��܂ȃ^���p�N���ɓK�p���A�����̃^���p�N���̃t�H�[���f�B���O�����ߒ���J�j�Y���𐳊m�ɗ\���ł��邱�Ƃ�������A�A�����̌��ʂɊ�Â��A�^���p�N���̃t�H�[���f�B���O�����@�\��I�ɗ�������A�B�^���p�N�����@�\������ۂ̍\���ω��i�_�C�i�~�N�X�j��\������A�C�y�f�����̑��x�ikcat, Km�j��\������A�D�^���p�N���̃A�~�m�_�u���ψّ̂ɂ��̗��_��K�p���A�����������x��y�f�������x���͂�߂��ψّ̂�v�\�ɂ���A�E�S�^���p�N���̍\���_�C�i�~�N�X�i���R�G�l���M�[�n�`�j��\�����A�����̃f�[�^�x�[�X������A�F���̃f�[�^�x�[�X��[�w�w�K���A�^���p�N���̃_�C�i�~�N�X��\������l�H�m�\�iAI�j������A�Ȃǂł��B���ꂱ�����A�|�X�gAlphaFold2����ɂ�����V���Ȍ����ł���A���̐��ʂ͑n���Y�Ɨ��p�Ȃǂɒ������Ă��܂��B�d�v�ȓ_�́A������\�Ƃ��邽�߂ɂ́A�����Ȋw�����ł͂Ȃ��A�����w����Ȋw�Ȃǂ��K�v�ɂȂ�Ƃ������Ƃł��B
�@���̑��ɁA�l�X�ȕ����w�I��@�ƍ��������v���@��g�ݍ��킹�邱�Ƃɂ��A�^���p�N���̃t�H�[���f�B���O�����ڊϑ����A���̔������x�⒆�ԑ̂̕`���𖾂炩�ɂ��錤�����s���Ă��܂��i���}�j�B�܂��A���q���͊w�V�~�����[�V�����Ȃǂ̗��_�I��@�ɂ��A���q���x���̕���\�Ńt�H�[���f�B���O�����̗l�q�𖾂炩�ɂ��邱�Ƃ�ڎw���܂��B���̂悤�ɗ��_�Ǝ����̗��ʂ���A�^���p�N���̃t�H�[���f�B���O���ۂɔ����Ă����܂��B
�@�^���p�N���̃t�H�[���f�B���O�����@�\�ɂ��Ă̒m���́A�Y�Ɨ��p�\�ȗl�X�ȃ^���p�N�����A��Ɠ��ōH�Ɛ��Y�����ł��ɂ߂ėL�p�ł��B��Â�Y�Ƃł́A���������^���p�N����in vitro�ŗp���邱�Ƃ������ł����A���̓�������o�����^���p�N���͕s����ň����ɂ����A�{���̋@�\���ł��Ȃ����Ƃ����X����܂��B�܂��A�זE�O�ɕ��傳���^���p�N���ɂ͑����̃W�X���t�B�h����������A������in vitro�Ō����I�ɍ������邱�Ƃ͎���̋Ƃł��B�������A�����������������ł���A��ÁE�Y�Ɨp�̃^���p�N���������ő�ʂɐ��Y�ł��A�^���p�N���̎Љ�p�𐄐i�ł��܂��B�������͑咰�ۂ�p�����^���p�N���̑�ʔ�����A�^���p�N���̃��t�H�[���f�B���O�i�����߂��j�A�^���p�N���̈��萫�̌����Ȃǂɂ����Ă������̌o����L���Ă��܂��B
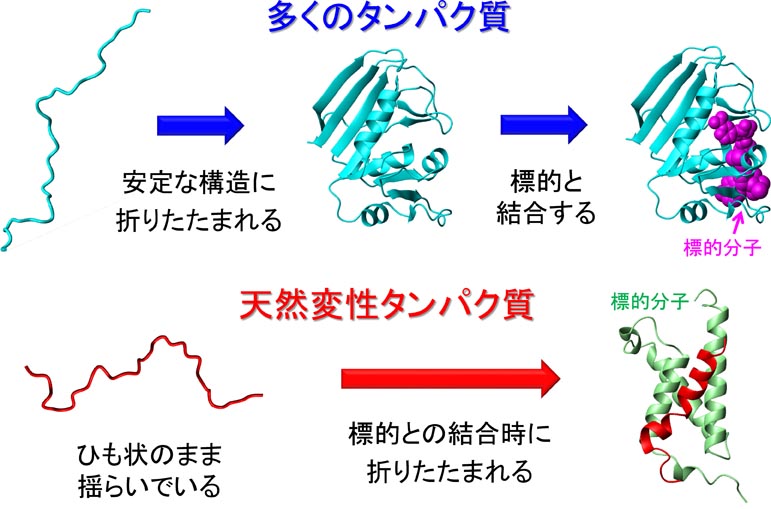
�i�Q�j�V�R�ϐ��^���p�N���̋@�\�����@�\�̉�
�@�]���A�^���p�N���́A����̗��̍\�����`�����ď��߂ċ@�\������ƍl�����Ă��܂����B�������A�ŋߔ������ꂽ�u�V�R�ϐ��^���p�N���v�́A�����I�������ł͕ϐ������\���������܂����A�W�I���q�̔F���Ƃ����@�\�����ɔ����ď��߂ăt�H�[���f�B���O���邱�Ƃ��킩��A�]���̌Œ�T�O�����������V���ȃp���_�C���ƂȂ��Ă��܂��B�������A�V�R�ϐ��^���p�N���͍������������^���p�N���̖�S�����߁A�]�ʁE�|��E�V�O�i���`�B�Ȃǂ̏d�v�Ȑ������ۂɊ֗^���Ă��܂��B�����ŁA�V�R�ϐ��^���p�N���̃t�H�[���f�B���O�ƕ��q�F���̃��J�j�Y���𖾂炩�ɂ��A�V�R�ϐ��^���p�N���̋@�\�����@�\�̉𖾂�ڎw���܂��B�@���݁A�����a�ȂǂɊւ��]�ʈ��qc-Myb��MLL�A�q�g�Ɖu�s�S�E�C���XHIV-1�R���̓V�R�ϐ��^���p�N��Tat�AHER2�����^���p�N��Herstatin�ȂǁA�a�C�Ɋւ��l�X�ȓV�R�ϐ��^���p�N���̍\����͂�A�W�I���q�F���@�\�Ȃǂɂ��Č�����i�߂Ă��܂��B����ɁA�����̒m�����A�����̎����̎��Ö�J���ɉ��p���邱�Ƃ��i�߂Ă��܂��B
�i�R�j�^���p�N���̍\���_�C�i�~�N�X��͂Ƌ@�\����@�̊J��
�@�^���p�N���́A�t�H�[���f�B���O���ē���̍\�����`���������ƁA�̂悤�Ɍł܂��Ă����ł͂���܂���B�^���p�N���͔M�I�h�炬�Ȃǂɂ���āA�܂�Ő����Ă��邩�̂悤�Ƀ_�C�i�~�b�N�ɓ����A���l�ȋ@�\�����܂��B�����̐��������Ƃ��������́A�^���p�N���̓����ɗR�����Ă���̂ł��B�����āA���̂悤�ȃ^���p�N���̐U�镑���͑S�āA�^���p�N���̃A�~�m�_�z��̒��Ƀv���O��������Ă��܂��B�@�����Ŏ������́A�^���p�N�����ǂ̂悤�ɓ����ċ@�\������̂����A�j���C���iNMR�j�����@�Ȃǂ�p���ĉ�͂��Ă��܂��B���ɁA�ł��_�C�i�~�b�N�ɓ����^���p�N���ł���V�R�ϐ��^���p�N����A�_�C�i�~�N�X�����ɂ������\�I�ȃ^���p�N���ł���W�q�h���t�_�Ҍ��y�f�iDHFR�j�Ȃǂ�p���Č�����i�߂Ă��܂��B
�@����ɁA����ꂽ�m���Ɋ�Â��āA�����̃^���p�N���������\���i���������j����ψّ̂��\�z���邱�Ƃɂ��A�^���p�N���̋@�\�𐧌䂷����@�̊J����ڎw���܂��B
�i�S�j�H�i�^���p�N���̕������
�@�H�i�̒��ɂ̓^���p�N���������܂܂�Ă��܂��B�Ⴆ�A�����ɂ̓����N�g�A���u�~��������N�g�O���u�����A���ɂ̓I�{�A���u�~����]�`�[���Ƃ������^���p�N������ʂɊ܂܂�Ă��܂��B�������͂���܂ŁA���������^���p�N���̃t�H�[���f�B���O��ϐ��Ȃǂ̕��������w�I�Ȏ�@��p���ďڍׂɉ�͂��Ă��܂����B�����̒m���́A�H�i���H�Ȃǂɂ����Ă��傢�ɖ𗧂Ɗ��҂���܂��B�i�T�j�זE���ł́u�t-�t�������v�̃��J�j�Y���𖾂Ɛ���@�̊J��
�@�V�R�ϐ��^���p�N���ɂ���Ĉ����N�������u�t-�t�������v�i���̂Ȃ��I���K�l���j�́A�זE�����w�ɂ�����ł��z�b�g�Șb��̂ЂƂł��B���̋@�\�𖾂Ɛ���@�̊J�����s���A�����������w�����Ƃ�ڎw���܂��B�܂��A�t-�t�������𗘗p���āA�y�f�Ȃǂ������I�ɂ͂��炭�������v���A���̐�����\�Ƃ��邱�Ƃɂ��A�������Y�ւ̉��p��ڎw���܂��B�i�U�j�~���[�^�m�[����͂Ɋ�Â��^���p�N���\�z�����̉�
�@�@�`����A�~�m�_�z�^����ꂽ�Ƃ��A�^���p�N���͂ǂ̂悤�ȗ��̍\�����`�����A
�@�@�@�ǂ̂悤�ȋ@�\������̂��H
�@�A�~�m�_�z����݂̂���A�^���p�N���̗��̍\���Ƌ@�\��\���\�ɂ��邱�Ƃ́A�����̃v���O��������ǂ��邱�Ƃ��̂��̂ł��B���̖�����������ɂ́A�z��E�\���E�@�\�ɂ��Ẵf�[�^�x�[�X���K�v�ł��B�����ŁA�^���p�N���ɗl�X�ȃA�~�m�_�u���ψق�ԗ��I�ɓ������A�e�ψّ̂̍\���Ƌ@�\�𑪒肷�邱�Ƃɂ��A�z��E�\���E�@�\�̃f�[�^�x�[�X���\�z���܂��B�����āA���̃f�[�^�x�[�X����͂��A�z����݂̂���^���p�N���̍\���E�@�\��\��������@���J�����邱�Ƃ�ڎw���܂��B���̂悤�ɁA�ԗ��I�ȕψّ̂̃f�[�^�x�[�X�Ɋ�Â���͂̂��Ƃ��A�~���[�^�m�[����͂Ɩ��t���܂��B�~���[�^�m�[���imutanome�j�Ƃ́A�ψّ́imutant�j�{���́i-ome�j�Ƃ����Ӗ��̑���ł���A�V���ȃI�~�N�X��͋Z�p�ł��B�@���݁A�A���J�������Ɋ֗^����y�f�����f���ɗp���āA�~���[�^�m�[���E�f�[�^�x�[�X�̍\�z���s���Ă��܂��B���̃f�[�^�x�[�X�\�z�́A�L�p�ȃ^���p�N���̃f�U�C���ɂ��������܂��B�@���ɁA�@�B�w�K��[�w�w�K�ɂ���ă^���p�N���̃A�~�m�_�z��E�\���E�@�\�̃f�[�^�x�[�X�𗝘_�I�ɉ�͂��A�A�~�m�_�z����݂̂���^���p�N���̗��̍\���Ƌ@�\��\��������@���J�����邱�Ƃ�ڎw���܂��B