「タンパク質の折りたたみ問題を解く」
タンパク質は、アミノ酸が平均数百個つながった長いひも状の分子です。ひも状ですので、長く伸びた形から丸めた形まで、多様な形をとることができます。生体内で作られたばかりのタンパク質は、長く伸びた形をしています(変性構造)。多くのタンパク質はこのままでは働くことはできず、らせん状やひだ状などの特定の形(天然構造)に折りたたまれて初めて機能を発揮できるようになります。
タンパク質を構成しているアミノ酸は基本的に20種類あり、それらの並び方はDNAの塩基配列、つまり遺伝子によって決められています。20種類のアミノ酸をアルファベットで表すと、タンパク質のアミノ酸配列は文字列で表されます(図1左)。アミノ酸配列が決まると、最終的につくられる天然構造(図1右)が決まります。このように天然構造になった後、他の分子とくっついたりすることで、タンパク質は本来の機能を発揮できるようになります。
では、あるアミノ酸配列が与えられたときに、そのタンパク質はどのような形をつくるのでしょうか? また、タンパク質はどのようなプロセスを経て最終的な天然構造へと折りたたまれていくのでしょうか? これらの疑問は「タンパク質の折りたたみ問題」と総称され、その問題の解決は生命科学における数十年来の難問中の難問でした。
上記の1つ目の問題を解決するために、多くの研究者が1950年代からこれまで、さまざまなタンパク質の立体構造をX線結晶構造解析、NMR分光法、クライオ電子顕微鏡などを用いた実験によって決定してきました。それらの20万以上のデータはProtein Data Bank(PDB)と呼ばれるデータベースに登録されています。しかしタンパク質の構造を実験で決めるためには時間とコストがかかるため、アミノ酸配列を入力したら立体構造をすぐに予測してくれるソフトウェアの開発が望まれていました。また、上記の2つ目の問題についても、長年、多くの研究者が研究を続けてきましたが、あらゆるタンパク質の折りたたみ反応過程を正確に予測することは困難でした。しかしついに最近、これらの難問が解かれつつあります。

図1 (左)タンパク質のアミノ酸配列の例(ヘモグロビン)。(中央)タンパク質の変性構造の例。
(右)タンパク質の天然構造の例(ヘモグロビンの単量体)。色は形を見やすくするために付けてある。
1.タンパク質の立体構造予測
2020年12月に、AlphaFold 2というソフトウェア(AI)が登場し、さまざまなタンパク質の立体構造を正確に予測することが可能になりました(文献1)。AlphaFold 2では、自然言語翻訳などで成功を収めたTransformerと呼ばれる深層学習モデルが使われており、タンパク質のアミノ酸配列という文字列を、言語における文のように扱うことで、折りたたまれたときにどのアミノ酸とどのアミノ酸が近くにあるのかを予測しました(文献2)。そして、タンパク質のアミノ酸配列と立体構造についての大量のデータを学習することでAlphaFold 2は完成しました。現在では世界中の研究者がこのソフトウェアを使っており、タンパク質研究における大きな貢献を果たしたことから、AlphaFold 2を開発したGoogle DeepMind社のデミス・ハサビス博士とジョン・ジャンパー博士は、2024年にノーベル化学賞を受賞しました。
なお、AlphaFold 2が予測できるのはタンパク質の天然構造だけであり、タンパク質が他の物質(低分子、核酸、金属など)と結合した構造は予測できませんでした。2024年に、このような構造も予測できるようにしたソフトウェアAlphaFold 3が開発されました(文献3)。また、類似のソフトウェアも次々と登場しています。
AlphaFold 2はアミノ酸配列と天然構造をつないでくれますが、タンパク質がどのようにして折りたたまれていくのか、そのプロセスや仕組みについては予測できず、ブラックボックスのままでした。
2.タンパク質の折りたたみ反応のプロセス
1960年代からこれまでに、私たちを含めた世界中の研究者がさまざまなタンパク質の折りたたみ反応過程を実験で詳細に調べてきました。その結果、アミノ酸100個以下からなる小さなタンパク質は単純な仕組みですばやく折りたたまることや、アミノ酸100個以上からなる大きなタンパク質では、反応の途中で中間的な構造を形成し、複雑なプロセスを経て折りたたまることなどが明らかになってきました(文献4,5)。
次にやるべきことは、実験結果を予測する理論の構築です。私たちは最近、タンパク質の折りたたみ反応過程を予測できる物理学理論(WSME-Lモデル)の構築に成功しました(文献6)。タンパク質は「自由エネルギー」と呼ばれるエネルギーができるだけ低くなるように構造を変えていくことが知られています。そこで私たちは、タンパク質のとりうる構造を示した地図に自由エネルギーの等高線を記入し、タンパク質がスタート(変性構造)からゴール(天然構造)まで到達する際にどのような経路を通過するのかを予測可能にしました(図2)。なお、この理論では入力としてタンパク質の天然構造が必要であり、PDBに登録されている構造や、AlphaFoldでの予測構造を用いることができます。今後はこの理論を用いて、あらゆるタンパク質の折りたたみ反応過程を予測していくことを目指しています。
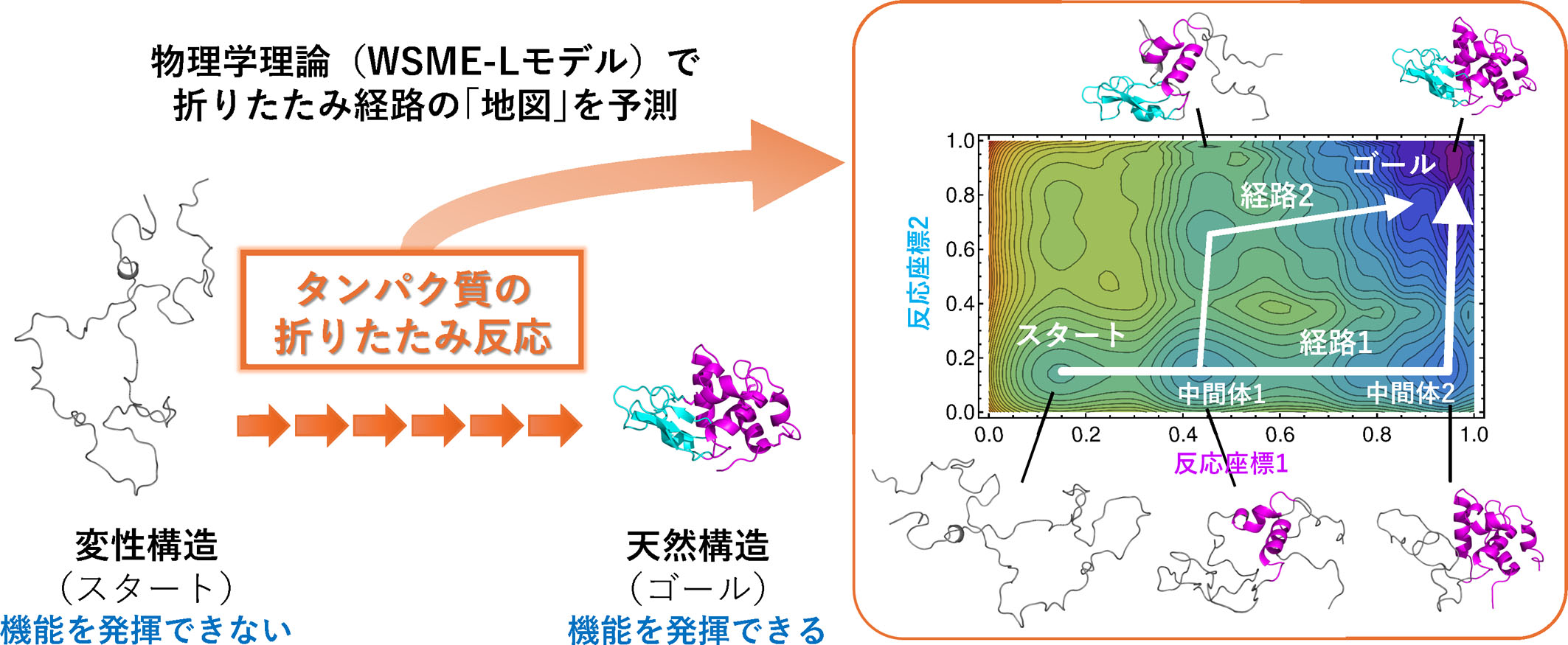
図2 「WSME-Lモデル」という物理学理論を用いれば、タンパク質の折りたたみ反応の経路を示す地図を予測できる。
例としてリゾチームのフォールディング反応の地図を示す。
3.タンパク質の変性
折りたたみ反応とは逆に、天然構造から変性構造へとタンパク質の形が変化することを、タンパク質の変性と呼びます(図1)。多くのタンパク質は天然構造になってから機能を発揮するため、変性すると機能を発揮できなくなります。生体内でタンパク質が変性すると疾患を引き起こす場合もあります。例えば、タンパク質がアミロイドと呼ばれる線維状の集合体を形成すると、アルツハイマー病やパーキンソン病、狂牛病などの疾患を引き起こすことが知られています。
タンパク質の構造は環境に対して敏感であり、高温、低温、酸性pH、アルカリ性pH、高圧などの条件下や、変性剤、有機溶媒、濃厚塩、界面活性剤などの添加、さらには攪拌、超音波、吸着などによっても容易に変性します。例えば、牛乳の中にあるカゼインというタンパク質は、酸性pHで変性して固まります。これがヨーグルトの主成分の一つです。またお菓子作りに使われるメレンゲはニワトリの卵白を泡立ててつくりますが、この中には攪拌によって変性したオボアルブミンというタンパク質がたくさん含まれています。ゆで卵の白身が固まるのも、オボアルブミンが高温で変性したためです。これらのタンパク質は、牛乳や卵の中に非常にたくさんあるので、酸、攪拌、熱などによって変性したときに、まわりにある他の分子とくっついてしまい、それによって固まります。
このように私たちが目にする変性反応ではタンパク質が固まっていることが多いですが、タンパク質の濃度が非常に薄いときには、タンパク質を変性させても他の分子とくっつかず、高温から低温に戻せば元の形に戻ります(ただし、タンパク質が大きくなると、元に戻すのは難しくなります)。変性や折りたたみのプロセスを詳細に調べるときには、私たちはこのように理想的な条件下での実験も行っています。
4.天然変性タンパク質
タンパク質は「多くの場合」、特定の構造へと折りたたまれてから機能を発揮すると上に書きました。ヒトが持つタンパク質の約60〜70%にはこれが成り立ちますが、実は、約30〜40%のタンパク質は、伸びた形のままで機能を発揮できます。これらのタンパク質は天然の条件下で変性した構造をしているため、「天然変性タンパク質」と呼ばれています(文献7)。
5.科学的・社会的意義
タンパク質の折りたたみ反応は、DNA→RNA→タンパク質というセントラルドグマの最終段階に位置しているプロセスであり、その仕組みを明らかにできたときに初めて、遺伝情報を解明できたと言うことができます。したがって、タンパク質の折りたたみ問題の解明は、生命科学における最重要課題の一つです。
近年、タンパク質は医療や産業などに多く使われています。医療においては抗体などのタンパク質が病原体の働きを阻害し、産業においては酵素などのタンパク質が有用な物質を生産しています。このように役立つタンパク質を新たに開発するためには、タンパク質の構造を知ることが必要であり、タンパク質の折りたたみについての知識が重要になります。特に、AlphaFoldなどのソフトウェア(AI)は今後、創薬などに大きく貢献するでしょう。
また、タンパク質を医療や産業などに使う際には、大量のタンパク質を実際に製造する必要があります。そのためには、タンパク質の折りたたみ反応過程をよく理解し、タンパク質を効率的に製造するプロセスの開発が必要になります。私たちが構築したWSME-Lモデルは、そのようなプロセス開発に役立つだけでなく、製造しやすいようにタンパク質を改変することにも利用可能です。さらに、タンパク質の折りたたみや変性の研究は、食品科学等にも密接に関係しています。
このように、タンパク質の折りたたみと変性は、基礎科学として重要なだけでなく、医療や産業などにも直結しています。21世紀は生命科学の時代であるとともに、情報科学の時代でもあります。これらが融合したところに最先端があり、タンパク質はまさにそのような最先端の研究分野です。今後、若い皆さんがこの研究分野にたくさん参入してくることを期待しています。また、企業等の研究者の皆様との共同研究も歓迎いたします。
参考文献
1) Jumper, J., et al. (2021) Highly accurate protein structure prediction with AlphaFold. Nature, 596: 583-589.
2) 季高, 新井 (2025) タンパク質は言語である〜2024年ノーベル化学賞,教養学部報,660: 1-2.
3) Abramson, J., et al. (2024) Accurate structure prediction of biomolecular interactions with AlphaFold 3. Nature, 630: 493-500.
4) Arai, M., & Kuwajima, K. (2000) Role of the molten globule state in protein folding. Adv. Protein Chem. 53: 209-282.
5) Arai, M. (2018) Unified understanding of folding and binding mechanisms of globular and intrinsically disordered proteins. Biophys. Rev. 10: 163-181.
6) Ooka, K., & Arai, M. (2023) Accurate prediction of protein folding mechanisms by simple structure-based statistical mechanical models. Nat. Commun. 14: 6338.
7) Arai, M., et al. (2024) Dynamics and interactions of intrinsically disordered proteins. Curr. Opin. Struct. Biol. 84, 102734.